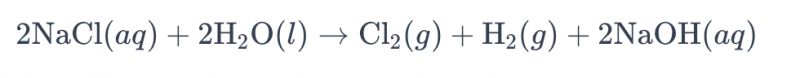A sóoldat titánelektródákkal történő elektrolízisének folyamatát, amely klór előállítását célozza, általában "sóoldat elektrolízisének" nevezik. Ebben a folyamatban titánelektródákat alkalmaznak a sóoldatban lévő kloridionok oxidációs reakciójának elősegítésére, ami klórgáz keletkezéséhez vezet. A reakció teljes kémiai egyenlete a következő:
Ebben az egyenletben a kloridionok oxidáción mennek keresztül az anódon, ami klórgáz képződéséhez vezet, míg a vízmolekulák redukálódnak a katódon, hidrogéngáz keletkezése közben. Ezenkívül a hidroxidionok redukción mennek keresztül az anódon, hidrogéngázt és nátrium-hidroxidot képezve.
A titán elektródák választása a titán kiváló korrózióállóságának és vezetőképességének köszönhető, amely lehetővé teszi, hogy az elektrolízis során stabilan, korrózió nélkül menjen végbe a reakció. Ez teszi a titán elektródákat ideális választássá sóoldat elektrolíziséhez.
A sós víz elektrolízise jellemzően külső áramforrást igényel az elektrolitikus reakció energiájának biztosításához. Ez az áramforrás általában egyenáramú (DC) tápegység, mivel az elektrolitikus reakciókhoz állandó áramáramlási irány szükséges, és egy DC tápegység állandó áramirányt tud biztosítani.
A sós víz elektrolízisének klórgáz előállításához történő folyamatában általában alacsony feszültségű egyenáramú tápegységet alkalmaznak. A tápegység feszültsége az adott reakciókörülményektől és a berendezés kialakításától függ, de általában 2 és 4 volt között van. Ezenkívül a tápegység áramerőssége egy kulcsfontosságú paraméter, amelyet a reakciókamra mérete és a kívánt termelési hozam alapján kell meghatározni.
Összefoglalva, a sós víz elektrolíziséhez szükséges tápegység kiválasztása a kísérletek vagy ipari folyamatok konkrét követelményeitől függ, hogy biztosítsák a hatékony reakciót és a kívánt termékek elérését.
Közzététel ideje: 2024. január 16.